2004年度の研究内容の概略
1-1. FD遺伝子とFT遺伝子の相互依存性
これまでの解析から、bZIP型転写因子をコードするFD遺伝子がFT遺伝子による花成促進に必要であることが明らかになった。FD遺伝子は、芽生えにおいては、主に茎頂分裂組織で発現し、機能を保持したEGFP:FD融合蛋白質を茎頂分裂組織の細胞で発現させると核局在が観察される。FD蛋白質はFT蛋白質と酵母細胞内、試験管内で相互作用能(結合能)を有する。機能を保持したFT:EGFP融合蛋白質を茎頂分裂組織の細胞で発現させた場合、核と細胞質に蛍光が観察されることから、FD蛋白質とFT蛋白質は核で相互作用すると考えられる。FD蛋白質の制御標的のひとつは花芽分裂組織遺伝子AP1であるが、FDによるAP1遺伝子の発現促進にはFT機能が必要であることが明らかになった。また、FD蛋白質のC末のリン酸化モチーフが、FT蛋白質との相互作用能、fd変異体の相補能、AP1遺伝子の転写活性化に必須であることが明らかになった。これらの知見はFT遺伝子とFD遺伝子は互いの機能を必要とすることを強く示唆する。
1-2. FT遺伝子機能の細胞非自律性
FT遺伝子は主に子葉・葉の維管束(篩部)で発現し、FD遺伝子が発現する茎頂分裂組織では発現がみとめられない。しかし、上述のようにこの二つの遺伝子の機能は蛋白質間の相互作用を介して相互に依存的であると考えられる。FD/FTによるAP1遺伝子の転写活性化は茎頂分裂組織でおこる事象である。これらは、FT機能が茎頂で必要とされることを示唆する。これを検証するため、FT機能の細胞非自律性について解析を進めている。
まず、ft変異体で種々の組織・細胞特異的なプロモーターによりFTを発現させることで、組織限定的なFT機能の回復実験をおこなった。その結果、本来の発現組織である子葉・葉の維管束篩部を含む維管束篩部組織における機能回復(SULTR2;1, rolCプロモーター)に加えて、主に茎頂分裂組織で発現し維管束では発現しないFDプロモーターや茎頂分裂組織のL1層特異的なPDF1プロモーターによる機能回復によっても、ft変異の花成遅延表現型が相補された。一方、根の維管束中心柱(IAA14プロモーター)や静止中心(QHB1/WOX3プロモーター)における機能回復の場合には、花成遅延表現型は相補されなかった(図1)。これらの結果は、FT機能は茎頂で必要とされるという見方を支持する。
これと並行して、胚軸接木法を用いた接木実験により、FT遺伝子の花成促進効果が接木面を介して伝達される可能性を検討している。これまでに、FT遺伝子を過剰発現させた形質転換体(35S::FT)の接穂をft変異体の台木に接木することで、台木の花成が大幅に促進されることを確認した。このことは、過剰発現させたFT遺伝子による花成促進は接木面を介して台木に伝達可能であることを示唆する。一割程度の成功率が得られること、接木処置そのものによる花成促進効果はみとめられないことなどから、胚軸接木法は解析手段として有効であると考えられる。様々な組合せで接木実験を進めている。
以上の結果は、FT機能の細胞非自律性を支持するもので、FT遺伝子産物が長距離伝達性の花成刺激であることを示唆している。今後これを検証していきたい。

図1 組織限定的なFT遺伝子の機能回復実験
左から、野生型、ft-3、SULTR2;1::FTを導入したft-3、PDF1::FTを導入したft-3、FD::FTを導入したft-3、IAA14::FTを導入したft-3の各植物。IAA14::FTの場合を除いて、ft-3変異の花成遅延表現型が回復している。スケールは1cm。
1-3. FT 蛋白質とTFL1蛋白質の相反する機能の分子基盤
FT蛋白質(175アミノ酸)とTFL1蛋白質(177アミノ酸)は同じPEBP/RKIPファミリーに属し、よく似た立体構造をとると予想される(図2)。しかし、花成における両者の役割は相反しており、FT蛋白質が花成を促進するのに対し、TFL1蛋白質は花成を抑制する。遺伝学的な解析から、両者の相反的なはたらきは、発現・活性の相互抑制を介したものではないと考えられる。一方、FT蛋白質と蛋白質間相互作用を介して相互依存的に機能すると考えられるFD蛋白質は、TFL1蛋白質とは極めて弱い相互作用能しか持たないことが判っている。
FT蛋白質とTFL1蛋白質の機能相反の分子基盤を明らかにする目的で、種々の改変蛋白質を発現させ、FD蛋白質との相互作用能、変異体の相補能などを解析している。特に、アミノ酸配列および予想立体構造の比較(図2)から、蛋白質表面にあって、相同性が低く構造が大きく異なる領域に着目している。この部分を入れ換えたキメラ蛋白質がFTあるいはTFL1のどちらとして機能するかを検討している。また、2つの蛋白質間で置換がみられるいくつかの残基を入れ換えた置換型蛋白質についても、同様の解析を進めている。さらに、それぞれの蛋白質の機能におけるN末端側の領域の重要性なども調べている。
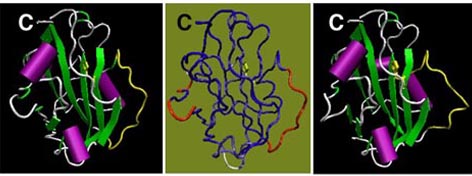
図2 FT, TFL1蛋白質の予想立体構造
哺乳動物のPEBP,キンギョソウのCENなどの構造にもとづき、ホモロジー・モデリング法により予測したFT蛋白質(3-166, 左と中央)とTFL1蛋白質(3-167, 右)の立体構造。CはC末端。N末端は向こう側に隠れている。FT蛋白質とTFL1蛋白質の間で保存性が低いループ領域を黄色で示している。中央の図では二つの蛋白質を重ね合わせたときに、Ca原子間の距離が近い領域を青色、遠い領域を赤色、中間的な領域を白色で表示している。
1-4. FTの相同遺伝子TSFの役割
機能欠損変異体と過剰発現体の表現型、発現制御の解析などから、TSF遺伝子はFT遺伝子と同様に花成経路統合遺伝子として機能することが明らかになった。TSF遺伝子の発現は、様々な点でFTの場合とよく似た制御を受けるが、2つの遺伝子の発現パターンは空間的には大きく異なる。これら二つの相同遺伝子の機能の重複と分化の分子基盤に関心を持って研究を進めている。
1-5. 優性のfwa変異における花成遅延の機構
これまでの研究から、FWA遺伝子は本来は花成制御には関与しないが、優性変異体では異所発現したFWA蛋白質がFT機能の阻害し、花成の抑制がおきることが明らかになった。FWA蛋白質は転写因子であると考えられるが、その異所発現は遺伝子発現に対してほとんど影響を与えないと考えられる。今後、FWA蛋白質を花成制御機構の一端を明らかにするツールとして研究を進めたい。
2-1. 頂端分裂組織の構造と機能を維持する機構
頂端分裂組織の構造と機能の維持におけるクロマチン構築因子群(CAF-1, ASF1等)の役割に焦点を当てて、研究を進めている。変異体を用いたASF1の機能解析、遺伝子発現のエピジェネティックな制御におけるCAF-1の役割、DNA複製後の速やかなクロマチン構築がゲノム安定性の維持に果たす役割などを共同研究により解析している。また、これらと関連する因子(BRU1)についての共同研究もおこなっている。
