2005年度の研究内容の概略
高等植物では、胚発生過程で構築されるのは胚のおおまかなボディープランのみであり、われわれが目にする植物体は、発芽後に主に頂端分裂組織で持続する後胚発生過程により形成される。後胚発生過程は、栄養成長相と生殖成長相という二つの相に区分される。われわれは、生活環の調節機構、特に二つの成長相間の転換過程である花成を制御する機構に興味を持ち研究を進めている。また、形態形成・相転換を通して頂端分裂組織の構造と機能が維持される機構についても研究をおこなっている。
1. 花成を制御する機構
花成を制御する分子機構の理解は、長日植物のシロイヌナズナを用いた研究により飛躍的に深まった。最近になり、短日植物のイネをはじめとして、エンドウ(長日植物)、コムギ(長日植物)等の植物においても制御経路の一端が分子レベルで解析され始めている。特に、イネにおいてはシロイヌナズナとの比較・対照を意識した研究が急速に進んでいる。われわれは、シロイヌナズナを用いた研究の意義は花成という研究領域にパラダイムを提供することにあるという認識に立ち、新たな先端を拓くことを目指して研究を進めている。一方で、florigenのように半世紀以上にわたって未解決の古典的な問題に対しても解決の糸口を与えたいと考えてきた。本年度はflorigenの実体解明に向けた大きな進展と評価される成果を上げることができた。
FD蛋白質とFT 蛋白質の蛋白質間相互作用
bZIP型転写因子をコードするFD遺伝子がFT遺伝子による花成促進に必要であることが明らかになり、その分子基盤として、蛋白質間相互作用が考えられる。これまでに、FD蛋白質とFT蛋白質が酵母細胞内、試験管内で相互作用能(結合能)を有することを示したが、今年度は植物細胞内における結合能をBiFC (bi-molecular fluorescent complementation)法によって確認した。BiFC法は結合能を調べようとする2つの蛋白質のそれぞれと、N末側半分とC末側半分に分割したYFP(YFPN, YFPC)の間で融合蛋白質を作成し、2つの蛋白質が結合する場合にYFPの立体構造が再生され、蛍光が観察されるという、原理に基づくものである(図1A)。
Nicotiana benthamianaの葉の表皮細胞を用いた一過的発現系を用いて、FD:YFPNとFT:YFPCを共発現させた場合に核にYFPの蛍光が観察されることを確認した(図1B)。FD蛋白質のC末のリン酸化モチーフが、酵母細胞内でのFT蛋白質との相互作用能に必須であることがわかっていたが、このモチーフに変異を持つFD:YFPNを用いた場合にはYFPの蛍光は観察されないことと合わせて、植物細胞内におけるFD蛋白質とFT蛋白質の結合能を示したことになる。35S::FD:YFPN, 35S::FT:YFPCを持つ形質転換シロイヌナズナを作出し、茎頂分裂組織の細胞における結合能の確認をおこなう予定である。
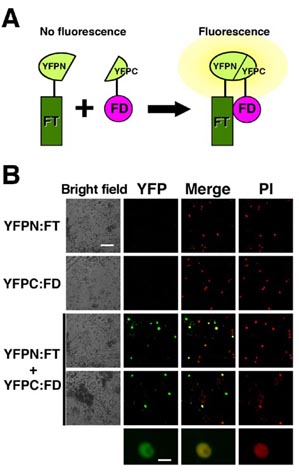
図1 植物細胞内におけるFT蛋白質とFD蛋白質の結合
A: BiFC法の原理。 B: 上段から、YFPN:FT単独、YFPC:FD単独、YFPN:FTとYFPC:FD(下の3段。最下段は核の拡大図)をそれぞれ発現させた表皮細胞。明視野像、YFP蛍光像、YFP蛍光像とPI蛍光像の重ね合わせ、PI蛍光像。再下段は核の拡大図。スケールは100mm(上の4段)と10mm(最下段)。
長距離花成シグナルとしてのFT 遺伝子産物
FT遺伝子とFD遺伝子に関するこれまでの解析結果を総合し、日長による葉の維管束篩部におけるFT遺伝子の転写誘導と茎頂における花芽形成のリンクとしてFD遺伝子を位置づけるとともに、FT遺伝子の産物(mRNA, 蛋白質)が長距離花成シグナル(florigen)の物質的実体であるというモデル(図2)を提唱した(論文4)。
これは、同時期に公表されたP. Wigge, D. Weigel両博士のグループの論文、O. Nilsson博士のグループの論文と合わせて、florigenの実体解明への大きな進展と評価され、Science誌が毎年の最終号で選ぶBreakthrough of the Yearの第3位にもランクされた。
実際には、輸送される分子の形態など未解決の問題が多く残っており、これからの研究の展開が期待される。
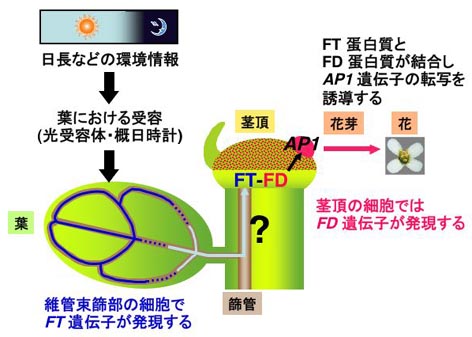
図2 FT遺伝子, FD遺伝子と長距離花成シグナル
光受容体と概日時計により適当な日長が受容されると、子葉・本葉の維管束篩部の細胞でFT遺伝子の転写が誘導される。一方、FT蛋白質は茎頂での細胞で機能すると考えられる。FT蛋白質は茎頂で特異的に発現するFD蛋白質と結合し、花芽分裂組織の発生運命の決定に関わるAP1遺伝子の転写を誘導する。子葉・本葉の維管束篩部の細胞で発現したFT遺伝子の産物(mRNA, 蛋白質のいずれか一方、あるいは両方)は篩管を通って茎頂まで輸送されると考えられる(図中の水色の矢印と?マーク)。
花成制御経路統合遺伝子としてのTSF
これまでの解析結果をまとめ、FT遺伝子の相同遺伝子であるTSF (TWIN SISTER OF FT)遺伝子を新しい花成制御経路統合遺伝子として位置づけ、維管束篩部が諸制御経路の統合の場であるという見方を提唱した(論文3)。TSF遺伝子の解析の過程で、もうひとつの経路統合遺伝子であるSOC1遺伝子がCOの直接の制御標的ではなく、FT, TSFの(FDには依存しない)制御標的である可能性が浮上した。同様の知見は海外のほかの2つのグループからも報告されており、制御経路の統合過程の階層性について再検討の必要性を考えさせるものである。
優性のfwa 変異における花成遅延の機構
FWA遺伝子の異所発現による花成阻害の分子機構に関して、これまでFT蛋白質との蛋白質間相互作用を中心に研究を進めてきたが、HD-ZIP蛋白質であるFWAが遺伝子発現の攪乱を介して花成を抑制している可能性も考えられる。そこで、マイクロアレイ解析とRT-PCR解析により、FWA遺伝子の異所発現(独立のエピアレル2系統と35S::FWA形質転換体1系統)による遺伝子発現の変化はほとんどないことを確認した。したがって、異所発現したFWA蛋白質が転写因子として花成制御カスケードを攪乱している可能性は考えにくい。
2. 頂端分裂組織の構造と機能を維持する機構
頂端分裂組織の構造と機能の維持におけるクロマチン構築因子群(CAF-1, ASF1等)の役割に焦点を当てて、研究を進めている。4月から新メンバーが加わり、asf1a; fas2, asf1b; fas2二重変異体の雄性不稔、asf1a; asf1b; fas2三重変異体の胚致死性に関して詳細な解析をおこない、興味深い知見が得られ始めている。
一方、これまで進めてきた、遺伝子発現のエピジェネティックな制御(トランスポゾン中の遺伝子の転写抑制、転写サイレンシングを受けたトランスジーンの転写抑制)におけるCAF-1の役割、DNA複製後の速やかなクロマチン構築がゲノム安定性の維持に果たす役割などに関する国立遺伝学研究所の柴原慶一助教授の研究室との共同研究の成果を公表した(論文1)。
