成長相転換(花成)の制御〜その2〜
1.4 複数の制御経路を統合する遺伝子
各制御経路の構成因子が明らかになってくると、次の大きな関心は、それらの経路を統合し、実際に花成を引き起こすものはなにかということになる。これまでその有力な候補と一般に考えられてきたのがLEAFY (LFY)遺伝子である。LFY遺伝子は、最も重要な花芽分裂組織決定遺伝子であり、この遺伝子を強制発現させることで、本来は花序(側枝)に分化するはずの分裂組織を花芽に分化させることができる。このため、LFY遺伝子は「花成のスイッチ遺伝子」とされることがある。しかし、一方で、LFY遺伝子の強制発現によっても花成の光周期依存性は失われないばかりか、花成そのもののタイミングもほとんど早まらないことが明らかになっている(ただし、本来側枝として発達するはずの分裂組織が花に分化するため、開花は大幅に早まる)。つまり、LFY遺伝子をいくら強制発現させても、植物はすぐに花を咲かせるというわけではない。このことは、LFY遺伝子は「花芽分化のためのスイッチ遺伝子」ではあっても、必ずしも「花成のスイッチ遺伝子」ではないことを意味する。見方を変えると、発現したLFY遺伝子に対する分裂組織の応答性を規定しているような遺伝子が他にあって、その遺伝子の働きなしには、直ちに花芽を分化することはできない、ということである。そして、そのような遺伝子の候補として、最も有力視されたのが、FT遺伝子である。
FT= FLOWERING LOCUS T?
FT遺伝子の"FT"は、本来は遺伝子の名称そのものであり、FLOWERING LOCUS Tという名称の略号ではなかった。同様のことは、M. Koornneef ら (1991) が記載した一連の花成遅延変異(late-flowering mutant)により定義される FCA, FD, FE, FHA, FPA, FVE, FWA の各遺伝子にも当てはまる。しかし、近年、FLOWERING LOCUS C (FLC) の例にならい、これら(FX)を、FLOWERING LOCUS Xの略号であると考える傾向が出てきている。
FT遺伝子に関しては、われわれのグループは DDBJ/EMBL/GenBank への塩基配列登録とCurr. Opin. Plant Biol. の総説では、FLOWERING LOCUS Tの略号であるとする現今の流れに従ったが、これは歴史的に見て必ずしも正しい扱いとは言えない。
これらの花成時期遺伝子の名称については、混乱と不統一を避けるため、今後、公的な調整が必要である。
1.5.1 FT遺伝子 - 機能喪失変異, 遺伝子の同定, 発現制御 -
FT遺伝子の機能喪失変異体(ft)は、M. Koornneefら (1991) により、花成遅延変異体(late-flowering mutant)のひとつとして報告された。ft変異体では、野生型植物で顕著に見られる長日条件による花成の促進がほぼ完全に消失し、花成までに要する時間(ロゼット葉数を指標に用いる)が長日条件と短日条件でほぼ同じになる。このため、長日条件下では、野生型に比べ顕著な花成遅延を示すことになる(図4)。fca等の花成遅延変異体では、春化処理により花成の遅延が緩和される(春化処理応答性を持つ)が、ft変異体は、co, gi, fha変異体等と同様に、春化処理応答性を持たない。こうした、生理学的特性に加えて、二重変異体の表現型解析から、ft変異体は、co, gi, fha変異体とともに、光周期(長日条件)による花成の促進経路に欠損があると考えられてきた。
この仮説を検証するため、われわれのグループは、T-DNA 挿入に伴う染色体欠失系統(Kaya et al. 2000)を用いて、FT遺伝子を同定した(Kobayashi et al. 1999)。FT遺伝子は同じシロイヌナズナのTERMINAL FLOWER1 (TFL1)遺伝子とよく似た構造と高い相同性を持つ遺伝子であった(図5A, 図5B)。2000年12月に終了したゲノム・プロジェクトの結果、シロイヌナズナのゲノム中に存在するFT, TFL1相同遺伝子は 、Kobayashi et al. 1999 の論文公表の時点で存在が判明していた6つのみであることが明らかになった(図5C)。これらの相同遺伝子のうち、ARABIDOPSIS THALIANA CENTRORADIALIS (ATC)遺伝子については、われわれのグループ、京都大学化学研究所(現・岡山県生物科学総合研究所)、岡山大学、ソーク生物学研究所(米国)の共同研究による論文を発表している(Mimida et al. 1999)。
FT遺伝子の発現は、非常に低レベルであるが、(1) 調べられた全ての組織でみとめられること(図6A)、(2) 花成の直前に発現量が極大になること(図6B)、(3) 長日条件により正に制御されること(図6C)、(4) 長日条件による正の制御にはCO遺伝子の機能が必要であること(図6C, 図6D)、等が明らかになっている(Kobayashi et al. 1999)。さらに、最近の研究から、CO蛋白質(Zn fingerを持つ転写因子)によるFT遺伝子の発現制御は、間に他の蛋白質の合成を介さない直接的な制御であることが示されている。

図4 ft変異体と野生型
長日条件(16時間明/8時間暗)で1ヶ月間生育させた植物。左パネル、右パネルともに、左側: Ler野生型株, 右側: ft-1変異株。右パネル中のスケールは1cm。
野生型ではすでに開花・結実がみとめられる(白いのが花)が、ft-1変異ではまだ花成の兆候が見られない。
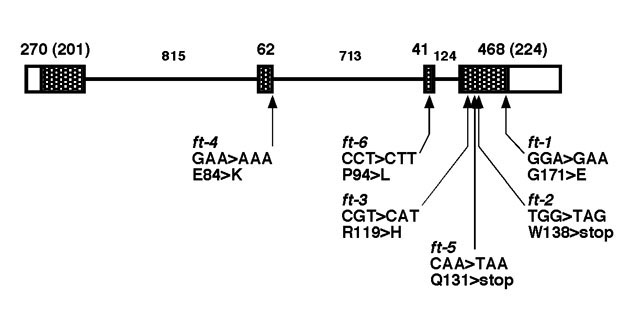
図5 FT遺伝子と遺伝子産物 -(A) FT遺伝子の遺伝子構造-
See Science 286(5446), 1960-1962 (1999).
エクソンとイントロンを、それぞれ箱と線とで表す。網掛けの部分はコード領域、数字は塩基対数である。FT遺伝子は第1染色体の下腕に座乗する。近傍の遺伝子の配列については、Plant Cell Physiol. 41(9), 1055-1066 (2000) を参照。
遺伝子構造の下に、エチルメタンスルフォン酸 (EMS) 処理により得られた6つのアレルにおける塩基置換とそれに伴う翻訳産物の変化を示す。

図5 FT遺伝子と遺伝子産物-
(B) FT遺伝子とその相同遺伝子の遺伝子産物のアミノ酸配列比較-
See Science 286(5446), 1960-1962 (1999).
FT, TSF (TWIN SISTER OF FT) (シロイヌナズナ), CiFT (ウンシュウミカン), OsFT (イネ), TFL1 (TERMINAL FLOWER1) (シロイヌナズナ) の各遺伝子産物とヒトのフォスファチジルエタノールアミン結合蛋白質 (hPEBP) の比較。最下段にコンセンサス配列を示し、FT 蛋白質のアミノ酸配列の上に (A) で示した6つのアレルにおける置換アミノ酸・終止コドンを示した。また、FT, TSF, TFL1で保存されているイントロンの位置を下向きの矢印で示した。
hPEBP の N 末の配列の下線は、上向きの矢尻の箇所で切断された後、hippocampal cholinergic neurostimulating peptide (HCNP) として機能する部分を示す((D)を参照
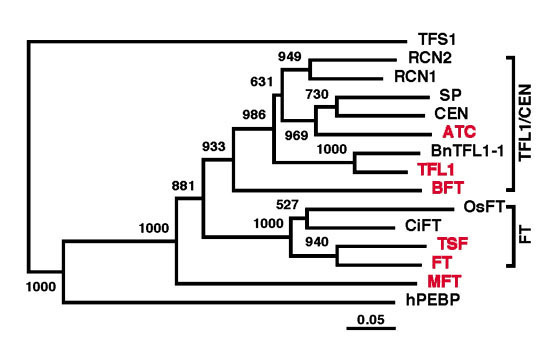
図5 FT遺伝子と遺伝子産物-
(C) アミノ酸配列比較に基づくNeighbor Joining 法による系統樹-
See Science 286(5446), 1960-1962 (1999).
(B) でアミノ酸配列比較をおこなった5つを含む植物由来の13の蛋白質、ヒトのフォスファチジルエタノールアミン結合蛋白質 (hPEBP)、酵母の TFS 蛋白質(外群)の系統樹。赤字で表した6つはシロイヌナズナ由来の蛋白質。数字は各枝の Bootstrap 値である。
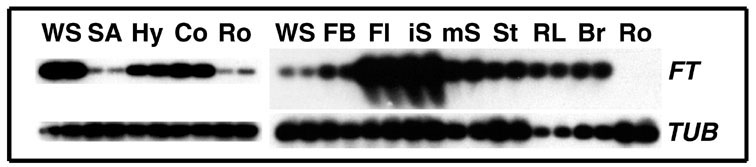
図6 FT遺伝子の発現
(A) 器官別の発現
(左パネル)6日齢の芽生えにおける発現(RT-PCR)
芽生え全体 (WS), 茎頂部 (SA), 胚軸 (Hy), 子葉 (Co), 根 (Ro) 。
(右パネル)成熟植物における発現(RT-PCR)
若い花蕾 (FB), 花 (Fl), 若い莢 (iS), 成熟した莢 (mS), 茎 (St), ロゼット葉 (RL), 茎葉 (Br), 根 (Ro) 。左端に右パネルの実験に用いた芽生え全体 (WS)の試料を比較のため加えている。beta-tubulin (TUB2) 遺伝子を RNA 量の参照に用いている。
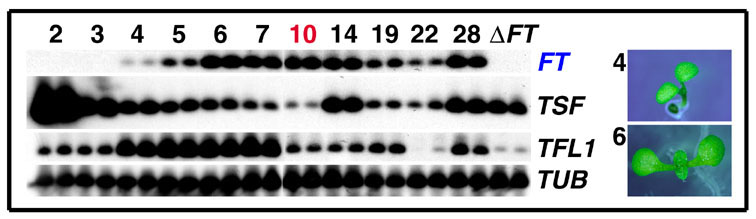
図6 FT遺伝子の発現
(B) 長日条件下におけるFT遺伝子の発現の経時変化
植物体地上部全体における発現(RT-PCR)
数字は植物の日齢で、赤字はAP1, AP3遺伝子の発現により推定したこの実験の生育条件における花成決定の日齢。右端には、4日齢(発現初期)、6日齢(発現極大期)の芽生えを示す。同じ試料におけるTSF, TFL1の発現も示す。beta-tubulin (TUB2) 遺伝子を RNA 量の参照に用いている。

図6 FT遺伝子の発現
(C) 光周期とCONSTANSによる発現制御
長日 (LD), 短日 (SD) 条件下の野生型(Col)と長日 (LD) 条件下のco-1における発現(RT-PCR)
数字は各区の植物の日齢。長日条件下の野生型に比べ、長日条件下のco-1あるいは短日条件下の野生型では、発現の立ち上がりが顕著に遅れる。 beta-tubulin (TUB2) 遺伝子を RNA 量の参照に用いている。
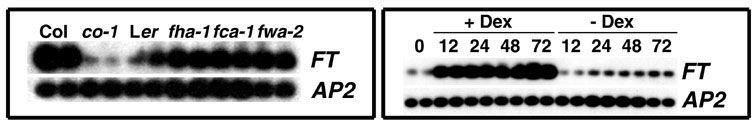
図6 FT遺伝子の発現
(D) CONSTANSによる発現制御
(左パネル)7日齢の芽生えにおける発現(RT-PCR)
野生型 (Col)とそれ由来のco-1変異体, 野生型 (Ler)とそれ由来のfha-1, fca-1, fwa-2変異体。co-1変異体で発現量の顕著な減少が見られる。
(右パネル)CO:GR 融合蛋白質による発現誘導(RT-PCR)
CO 活性がCaMV 35S プロモータの制御下にあるCO:GR 融合蛋白質のみによって供給される形質転換植物を用いて、融合蛋白質をデキサメタゾン処理(+Dex)により活性化して、CO 活性に依存したFT遺伝子の発現増加を調べた。数字は Dex 処理後の時間(時間)。-Dex は対照の溶媒のみによる処理。
APETALA2 (AP2) 遺伝子を RNA 量の参照に用いている。
